The lacking typographic design can mostly be explained by historically determined legal and economical requirements. European legislation, for example, demands a conservative approach, mainly to reach standardization. The pharmaceutical industry is hesitant, out of fear that the changes will come at high costs. Both explanations make it difficult to meet the professional principles of typographic designers striving for optimized transfer of information. This is the crux of the matter, the reason why convenient, readable medication information leaflets are in short supply.
This article examines two underlying questions. When it comes to drug information, there have been three pivotal changes in society: patients are more actively involved in their own treatment; patients’ cultural backgrounds are more diverse; and there is a growing demand for digital information. The first question is: why have these changes in society barely made an impact on the typographic design of information leaflets? The second question is: why is existing professional knowledge hardly utilized, such as insights into readability, or the practical knowledge and experience developed for the pharmaceutical industry by prominent representatives of the Swiss Typography (= ‘International Typographic Style’)?
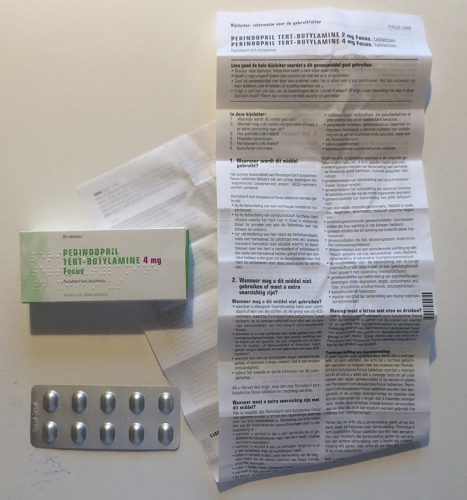
Informatie is een onmisbaar ingrediënt van ieder geneesmiddel. Om een geneesmiddel te identificeren, de risico’s in te schatten, de juiste gebruikswijze te onderstrepen, de bijwerkingen te herkennen en het correct te bewaren, zijn duidelijke adviezen en instructies noodzakelijk. Op dit moment wordt deze informatie gegeven in een bijsluiter: een lange tekst in kleine letters gedrukt op heel dun papier. De bijsluiter wordt daarna veelvuldig gevouwen en in een medicijnendoosje aan de patiënt geleverd. Het is al de vraag of deze wijze van informatieverschaffing in het verleden voldeed. Maar in het licht van recente maatschappelijke ontwikkelingen kan met zekerheid gesteld worden dat de huidige inhoud en de vorm van bijsluiters niet meer voldoet.
Dat heeft alles te maken met veranderingen in de positie van de medicijnengebruiker. Zo zal het gebruik van medicijnen zeer waarschijnlijk blijven toenemen. Niet alleen vanwege de dubbele vergrijzing (meer ouderen, en meer oudere ouderen), maar ook door de toename van het aantal beschikbare medicijnen, en het toenemende gebruik van preventieve medicijnen. Daarnaast zullen vaker combinaties van verschillende medicijnen worden voorgeschreven. Voor de oudere patiënten is het normaal om meer dan vijf en soms meer dan tien verschillende medicijnen per dag in te nemen (dit verschijnsel wordt aangeduid met de term ‘polyfarmacie’).
Verder worden patiënten steeds mondiger en wordt hun rol in hun medische behandelingen belangrijker en, vooral ook, actiever. Dan is betrouwbare, toegankelijke en begrijpelijke informatie voor patiënten van vitaal belang. Het ligt voor de hand hierbij gebruik te maken van informatie over medicijnen in een digitale vorm. Dit is urgent omdat de informatie over medicijnen die op het internet wordt verspreid niet altijd betrouwbaar is. Dat maakt de rol van een apotheker om betrouwbaremedicijnen en betrouwbare informatie te leveren nog groter. Voor veel patiënten is dit het laatste contact met een zorgverlener voordat ze een medicijn gebruiken. Tot slot moet de patiënt kunnen controleren of de geleverde medicijnen ook ‘echt’ zijn – een urgente kwestie vanwege de toename van het aantal illegale en namaak (gekopieerde) medicijnen die, met name, via het internet worden verkocht. Dat vraagt om aanvullende, zichtbare ‘veiligheidskenmerken’, die bewijzen dat de herkomst van de geneesmiddelen en de bijbehorende informatie juist zijn.
Het is dus de vraag of de bestaande bijsluiters nog voldoen aan de eisen die het gevolg zijn van de recente maatschappelijke veranderingen. Hierbij kunnen drie perspectieven worden onderscheiden: die van de patiënten, de farmaceutische industrie1 die bijsluiters produceren, en de overheid2 die de inhoudelijke informatie over medicijnen moet controleren.
Om een antwoord te kunnen geven op de vraag of bestaande bijsluiters nog voldoen aan de actuele eisen, is eerst een korte schets nodig van de huidige situatie. De typografische vormgeving van informatie over medicijnen kan het best worden verhelderd vanuit het eerste perspectief, dat van de patiënt. Medicijnen worden ruwweg in vier groepen onderverdeeld. Deze classificatie is gebaseerd op de manier waarop medicijnen worden gekocht (bij de drogist, of via arts en apotheek) en de manier waarop ze worden toegediend (zelf innemen, met behulp van een apparaat, of met assistentie van een zorgprofessional). Hieronder worden de vier groepen kort toegelicht.
Groep 1: Zelfzorgmedicijnen
Zelfzorgmedicijnen zijn ‘veilig genoeg’ om, voor een korte periode en in een relatief lage dosering, zonder professionele begeleiding te consumeren. Ze worden altijd in een beperkt aantal eenheden per verpakking verkocht. Voorbeelden van zelfzorgmedicijnen zijn pijnstillers, hoestdranken,neusdruppels en maagtabletten. De overheid stimuleert zelfmedicatie om de zorgkosten te drukken. Deze middelen scheppen voor de farmaceutische industrie een grote afzetmarkt: in Nederland gebruikten in 2013 28% van de mannen en 39% van de vrouwen in de twee weken voorafgaand aan de vraag zelfzorgmedicijnen.3
Naast de gereguleerde zelfzorgmedicijnen bestaat er nog een groot arsenaal aan producten, zoals kruiden, homeopathische middelen, voedingssupplementen, vitaminepreparaten en partydrugs, die als ‘zelfzorggeneesmiddelen’ worden geclassificeerd. De legale status van deze producten staat voortdurend ter discussie, maar om verschillende redenen vallen ze buiten de huidige geneesmiddelenwetgeving.
Groep 2: Receptplichtige medicijnen
De tweede groep medicijnen wordt voorgeschreven door een arts en geleverd door een apotheker. Dit kan gaan om een korte antibioticumkuur van een paar dagen, of het langdurig gebruik van cholesterolverlagers, bloeddrukverlagers, middelen tegen hartritmestoornissen, anticonceptie pillen of HIV-geneesmiddelen. De keuze en afgifte van receptplichtige medicijnen is sterk gereglementeerd. In Nederland wordt vaak het goedkoopste medicijn meegegeven (‘preferentiebeleid’). Dit kan een gepatenteerd merkgeneesmiddel zijn maar ook een exacte kopie (‘generiek geneesmiddel’). Hoewel het actieve ingrediënt in beide gevallen identiek is, zien de verpakking en de bijsluiter er (voor velen verwarrend) anders uit. Iets meer dan 70% van de receptplichtige medicijnen in Nederland zijn generieke geneesmiddelen.4
In Europa consumeren ouderen het grootste deel van de receptplichtige medicijnen. Vaak worden meerdere medicijnen tegelijkertijd genomen. In Nederland gebruikt ongeveer 35 % van de inwoners ouder dan 65 jaar twee geneesmiddelen en ongeveer 5 % meer dan 5 geneesmiddelen per dag.5
Groep 3: Medische hulpmiddelen
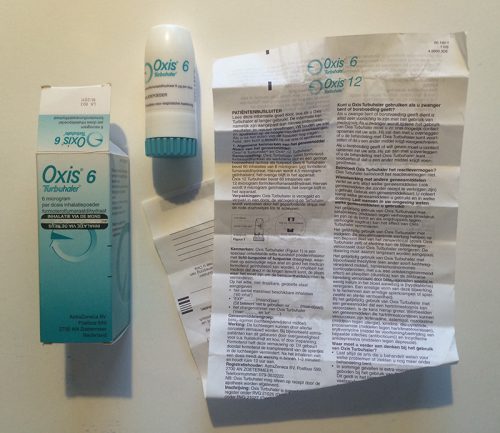
In het geval van de derde groep kan het geneesmiddel alleen met een specifieke toedieningsvorm worden gebruikt. Bekendste voorbeelden zijn de inhalator voor astmapatiënten en de insulinepen voor mensen met diabetes. Voor het correcte gebruik van deze hulpmiddelen worden de patiënten uitgebreid getraind. Meer complexe hulpmiddelen worden vaak onder directe begeleiding van een professionele zorgverlener gebruikt. Het is opmerkelijk dat de ‘medische hulpmiddelen’ en geneesmiddelen niet in dezelfde wetgeving worden geregeld. Met als gevolg dat een patiënt vaak twee keer informatie krijgt: een gebruiksaanwijzing voor het hulpmiddel en een bijsluiter voor het medicijn.
Groep 4: Medicijnen voor professioneel gebruik
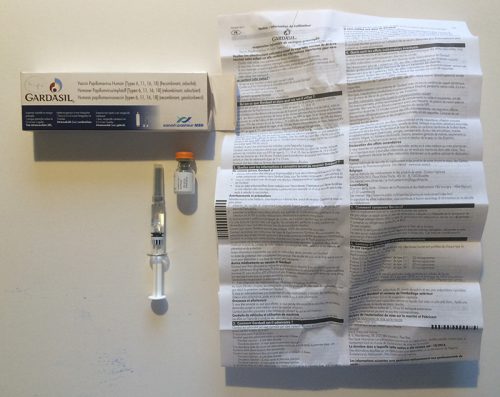
De vierde groep omvat geneesmiddelen, zoals injecties, infusies en anesthesiemiddelen, die door professionele zorgverleners in klinieken, rusthuizen en ziekenhuizen aan patiënten worden toegediend. Ook vaccinaties behoren in deze groep. Het is onwaarschijnlijk dat patiënten de verpakking of bijsluiter van deze geneesmiddelen te zien krijgen.
Bovenstaande voorbeelden illustreren dat de informatie over medicijnen momenteel visueel erg op elkaar lijkt. Geneesmiddelen worden meestal verpakt in een buitenverpakking (een kartonnen doosje) en een binnenverpakking (een doordrukstrip, een flesje, een tube). De bijsluiter wordt met de binnenverpakking in de buitenverpakking gestopt.
De typografie op de bijsluiters (en verpakkingen) is, niet alleen in Nederland maar overal in de Europese Unie, vaak bijzonder pover en eenvormig. De lettergrootte is erg klein en de regels zijn dicht op elkaar gezet. Vaak worden magere en smalle varianten van een lettertype gebruikt. Het dunne papier is doorschijnend, waardoor het contrast van de tekst en de achtergrond suboptimaal is. In de 28 landen van Europa gaat het in totaal om ongeveer 280.000 producten die sterk op de hierboven getoonde voorbeelden lijken. Er zijn enkele uitzonderingen die niet aan dit beeld voldoen, zoals de informatie en verpakking van Cimzia6 en sommige insulinepennen (NovoPen Echo).
De huidige visuele eenvormigheid is de resultante van een aantal historische ontwikkelingen. Voor 1992 had ieder land in Europa nationale regels die per land enorm verschilden. In België bijvoorbeeld werden soms twee bijsluiters (één voor de arts en één voor de patiënt) geleverd en in Denemarken waren bijsluiters absoluut verboden. Het Europese streven naar een vrij verkeer van goederen lag ten grondslag aan nieuwe wetgeving. In 1992 werd in Richtlijn 92/27/EEG7 de schriftelijke informatie over medicijnen verplicht gesteld en gestandaardiseerd. De farmaceutische industrie moest vanaf dat moment alle medicijnen van een bijsluiter voor patiënten voorzien.
De richtlijn uit 1992 voorzag ook in richtsnoeren voor ‘de leesbaarheid van de onderdelen op de etikettering en de bijsluiter.’ Deze ‘Readability Guideline’ verscheen zes jaar later in 1998 en had primair ten doel om de leesbaarheid van de informatie op de verpakking en bijsluiter te standaardiseren.8 De Guideline bestaat uit drie onderdelen: typografische adviezen, een sjabloon met een voorbeeldtekst en een testmethode om te bepalen of bijsluiters inderdaad leesbaar zijn. De typografische adviezen stelden bijvoorbeeld dat de minimale tekstgrootte voor een bijsluiter ‘7 Didot-punten’ moet zijn en dat een zin maximaal twintig woorden mag bevatten.
In 2009 werd de tweede versie van de Readability Guideline gepubliceerd waarin slechts twee aspecten worden onderscheiden, de typografische adviezen en de beschrijving van een testmethode.9 De sjabloontekst, met de verplichte structuur en tekstonderdelen op de verpakking en de bijsluiter, werd vanaf dat moment uitgegeven door de European Medicines Agency (EMA) in Londen. Deze sjabloon (de ‘QRD-template’)10 bevat alle teksten die verplicht in elke bijsluiter moeten worden opgenomen. Het is nauwelijks mogelijk om wijzigingen in deze standaardteksten aan te brengen, ook de volgorde ligt vast. Deze sjabloon is de afgelopen jaren verder ontwikkeld en de huidige tiende versie is beschikbaar in 24 talen. Iedere nieuwe versie bevat meer verplichte onderdelen waardoor de tekst in bijsluiters steeds langer wordt.11
De Readability Guideline uit 2009 is niet in het Nederlands vertaald, vandaar dat de Engelstalige termen doorklinken in de beschrijvingen hieronder. De typografische adviezen gaan over ‘Type size and font’, ‘Design and layout of the information’ en ‘Print colour’. Hieronder een paar voorbeelden van deze adviezen en hun praktische bruikbaarheid. De eerste regel onder de titel ‘Type size and font’ luidt: ‘Choose a font which is easy to read’, waarna een advies over de lettergrootte in een bijsluiter volgt: ‘The type size should be as large as possible to aid readers. A type size of 9 points, as measured in font “Times New Roman”, not narrowed, with a space between lines of at least 3 mm, should be considered as a minimum.’ Het tweede advies luidt: ‘Do not use italics and underlining as they make it more difficult for the reader to recognize the word-shape.’12 Beide adviezen lijken op het eerste gezicht duidelijk en eenvoudig toepasbaar, ofschoon toelichtende instructies en motivaties ontbreken. De Guideline beschrijft bijvoorbeeld niet hoe een font gekozen moet worden. Er zijn ook geen verwijzingen naar bronnen die aangeven waarom ‘9 punt’, ‘gemeten in lettertype Times New Roman’ en ‘3 mm’ als standaard werden gekozen. Het negatieve advies over het gebruik van cursief en onderlijning wordt wel gemotiveerd, maar ook hier ontbreekt een bronvermelding.
De adviezen over ‘Design and layout of the information’ zijn nog moeilijker te volgen. Een eerste advies stelt: ‘The use of “justified” text (that is text aligned to both left hand and right hand margins) should in principle not be used.’ Maar nergens wordt aangegeven welke vorm van regelval wel de voorkeur verdient. Een volgend advies luidt dat ‘Line spaces should be kept clear.’ Het is onduidelijk wat hiermee bedoeld wordt en wat de achtergrond voor dit advies is. Ook voor het advies dat ‘A column format for the text can help the reader navigate the information’, ontbreekt de verwijzing naar een bron; het is echter in alle Europese schriften (Latijn, Grieks, Cyrillisch) onmogelijk om geen kolommen te gebruiken.
De bovenstaande voorbeelden laten zien dat het in de praktijk erg lastig is om de typografische adviezen uit de Readability Guideline direct toe te passen. Zelfs als een tekst in een grootte van 9 punt, in het lettertype Times New Roman, met een regelafstand van 3 mm, linkslijnend, in een kolom wordt gezet, is het onwaarschijnlijk dat dit voor alle informatie, in alle talen, voor alle medicijnen, in alle gebruikssituaties optimaal is. De Readability Guideline is voor twee groepen relevant: de farmaceutische industrie en de registratie-autoriteiten. De industrie moet de Guideline als uitgangspunt nemen voor het ontwerp van de bijsluiters. De Guideline houdt echter geen rekening met de productie-eisen van de farmaceutische industrie. De beschikbare machines en productielijnen kunnen niet snel aangepast en vervangen worden. De afmetingen en vouwwijzes van bijsluiters staan vast en kunnen alleen aangepast worden door nieuwe verpakkingsmachines te ontwikkelen. Dergelijke investeringen nemen vaak jaren in beslag, ook omdat ze moeten passen in een globaal beleid van een bedrijf. Vandaar dat een eenvoudige toename van de lengte van de tekst in een bijsluiter meestal leidt tot nog kleinere letters. Het zijn voornamelijk de economische overwegingen die bepalen dat de adviezen over leesbaarheid worden genegeerd.
De registratie-autoriteiten moeten controleren of de informatie voldoet aan de wettelijke eisen. Zij vergelijken de inhoud met de tekstsjabloon en de vormgeving met de adviezen uit de Guideline. Het is in de praktijk vaak een onmogelijke opgave om vragen als ‘Is deze tekst gezet in 9 punt?’ en ‘Worden er kolommen gebruikt?’ te beantwoorden. Door de onduidelijkheden in de Guideline kijken de registratie-autoriteiten tijdens de registratieprocedure voornamelijk naar de inhoud van bijsluiters en nauwelijks naar de typografische vormgeving.
De huidige vormgeving van de bijsluiters is dus historisch gegroeid. De verschillen tussen patiënten, gebruikssituaties, culturen, farmaceutische industrieën en talen lijken nauwelijks invloed te hebben gehad op de inhoud of de vormgeving van de bijsluiters. Ook is niet geanticipeerd op recente maatschappelijke ontwikkelingen, zoals de toenemend actievere rol van patiënten in hun behandeling, de groeiende variatie in culturele achtergronden en de toenemende vraag naar digitale informatie.
Uitgangspunt van de huidige wetgeving is dat het voor de registratie-autoriteiten mogelijk moet zijn om informatie over medicijnen te controleren. Standaardisatie is de eenvoudigste manier om dat te bereiken. Sinds 1992 werden zowel de medicijnen zelf als de informatie in bijsluiters en op verpakkingen volledig gestandaardiseerd. Controle van de langere en steeds complexere tekst in de QRD-sjabloon is echter, door het toegenomen aantal medicijnen in steeds meer talen, veel ingewikkelder geworden.
In 2010 is besloten dat de Europese Commissie in 2013 zou rapporteren over de ‘tekortkomingen’ in de huidige wetgeving op het gebied van de leesbaarheid, opmaak en inhoud van bijsluiters.13 Het rapport werd uiteindelijk in 2015 gepubliceerd en bestond uit twee documenten. Het eerste document was een literatuurstudie en het tweede document een voorstel om iedere bijsluiter te beginnen met een ‘samenvatting van de belangrijkste punten’.14 Alhoewel beide rapporten zeer zorgvuldig zijn samengesteld, ontbreekt helaas een kritische reflectie op de problemen die veroorzaakt worden door de combinatie van wetgeving, richtlijnen en de bijsluitersjabloon (de QRD-template). En hoewel hier in 2010 expliciet om werd gevraagd, bieden beide rapporten geen praktische oplossingen voor een verbetering van het ontwerp en de controle van bijsluiters en verpakkingen.
De huidige wetgeving gaat er impliciet van uit dat alle patiënten in Europa op een vergelijkbare manier lezen, begrijpen en handelen. Bovendien wordt verondersteld dat alle medicijnen vergelijkbaar zijn en dat de informatie over deze medicijnen volledig gestandaardiseerd kan worden in zowel inhoud als structuur. Met als gevolg dat er slechts één standaardformaat beschikbaar is.
Het is eenvoudig om studies te vinden die aantonen dat de inhoud en vormgeving van bijsluiters niet voldoet, en omgekeerd bestaan er geen studies die aantonen dat de Europese bijsluiters optimaal functioneren. Het meest recente literatuuroverzicht geeft aan dat de informatie op bijsluiters niet duidelijk, niet begrijpelijk en vaak onvindbaar is.15
In 2014 werden 48 bijsluiters vergeleken op geschiktheid voor ouderen. De conclusie luidt dat ‘de huidige beschikbare bijsluiters niet geschikt zijn voor ouderen om hun medicijnen effectief te beheren.’16 De verplichte leesbaarheidstest blijkt ook geen garantie. Een onderzoek van Henk Pander Maat en Leo Lentz toont duidelijk aan dat geen van de drie onderzochte Nederlandse bijsluiters aan de eisen van de verplichte leesbaarheidstest voldeed.17 Andere studies stellen dat patiënten vaak speken over ‘een pover visueel ontwerp’ als het over bijsluiters gaat en dat bijsluiters met een hogere score voor vormgeving ook hoger scoren op de waardering voor de inhoud.18 Het literatuuroverzicht uit 2014 concludeert daarom ook dat de richtlijnen en sjablonen moeten worden aangepast en de vragen en belangen van patiënten uitgangspunt moeten vormen voor een heroverweging van de ontwerpprocessen19 Het ligt dan voor de hand om hierbij ook de presentatie van digitale informatie over medicijnen op allerlei vormen van beeldschermen te betrekken.
De rapportage van Europese Commissie over de ‘tekortkomingen’ had kunnen leiden tot een aanpassing van de wetgeving. Vandaar dat de farmaceutische industrie de afgelopen zeven jaar een afwachtende houding heeft aangenomen. Door ervaring wijs geworden probeert men de risico’s te verkleinen. Immers te snel reageren of onjuist anticiperen op wetgeving kan hoge kosten met zich mee brengen.
Hoewel de farmaceutische industrie af en toe kritiek had op de praktische toepassing van de complexe wetgeving,20 hield men zich over het algemeen nauwkeurig aan deze wetgeving om de licenties snel en probleemloos te verkrijgen (‘Regulatory compliance’). De eenvoudigste manier om aan te tonen dat men aan de wetgeving voldoet – en zo discussies over het visuele ontwerp te vermijden – is door de inhoud en vormgeving van bijsluiters die al zijn goedgekeurd nauwkeurig te kopiëren.
De kosten om een bijsluiter te ontwikkelen en ‘up-to-date’ te houden in de 24 talen en 28 landen van de Europese Unie zijn fors. Nauwkeurige en controleerbare cijfers ontbreken maar informeel worden de interne ontwikkelingskosten voor een nieuwe bijsluiter van een redelijk complex geneesmiddel geschat op 600.000 euro. De jaarlijkse onderhoudskosten bedragen ongeveer 100.000 euro, de productiekosten komen daar nog bij. Daarbij wordt de bijsluiter door de industrie niet als een onderdeel van de dialoog met patiënten gezien, maar eerder als een verplicht onderdeel van het registratieproces.
Opmerkelijk is dat alle wetgeving en richtlijnen uitgaan van papieren bijsluiters. Zelden wordt verwezen naar de ontwikkeling van digitale informatiesystemen. Bij de introductie van de wetgeving in 1992 was dit uiteraard begrijpelijk, maar gezien het huidige gebruik van smartphones, tablets en laptops zou dit toch meer op de voorgrond kunnen staan. De registratie-autoriteiten reageren echter zeer terughoudend als het gaat over het aanbieden van informatie over medicijnen op het internet. Uiteraard mag men de goedgekeurde bijsluitertekst op een website plaatsen en de link naar deze website in de bijsluiter of op de verpakking vermelden. Op de website zelf echter mag nauwelijks andere informatie worden geplaatst, omdat deze dan als ‘promotioneel’ wordt gekwalificeerd. Men kan natuurlijk wel op meer indirecte manieren informatie verschaffen, via de sponsoring van de websites van patiëntenverenigingen of het aanbieden van ‘educatieve materialen’. Over het algemeen echter staat het aanbieden van gedetailleerde en individuele informatie over geneesmiddelen in een digitaal formaat nog in de kinderschoenen.
Uit het bovenstaande blijkt dat de overheden, patiënten en industrie er, elk vanuit hun eigen perspectief, belang bij hebben dat de wetgeving wordt aangepast. Vanuit alle drie de perspectieven – overheid, patiënten en industrie – zijn er zwaarwegende redenen om de informatie over medicijnen in bijsluiters opnieuw te overwegen. Zowel de inhoud als de typografische vorm is daarbij belangrijk. Hieronder worden de uitgangspunten van de vorm besproken om te kunnen beoordelen hoe de vormgeving van bijsluiters aangepast zou kunnen worden om beter te beantwoorden aan de verwachtingen van de overheid, patiënten en industrie.
Kennis over de typografie en de lay-out van gedrukte teksten en illustraties komt voort uit de beroepsmatige ervaring van drukkers, handzetters, typografen, grafisch ontwerpers, fotozetters en desktoppublishing studio’s. De kern van deze kennis wordt al meer dan 500 jaar doorgegeven en onderzocht. Daarnaast wordt er wetenschappelijk onderzoek verricht naar de leesbaarheid van letters en teksten.21 Er is echter nauwelijks een kritisch debat over de relevantie en bruikbaarheid van deze kennis. In een recent nummer van Visible Language dat reflecteerde op 50 jaar typografie, wordt betoogd dat er nog veel onzekerheid bestaat over de kwaliteit van typografisch onderzoek.22 Het gebrek aan empirisch onderzoek, tezamen met het ontbreken van een kritisch debat over de relevantie van het onderzoek, wordt zowel door de farmaceutische industrie als de overheden ervaren als een lacune.
De praktische kennis van typografen en ontwerpers werd waarschijnlijk niet gebruikt voor de ontwikkeling van de Guideline, omdat richtlijnen op betrouwbare feiten (‘evidence based’) gebaseerd moeten zijn. In de typografische praktijk is het echter niet gebruikelijk om dit soort ‘bewijzen’ te leveren. Eenvoudige vragen als ‘Kunnen patiënten dit makkelijk lezen?’, ‘Is dit toepasbaar en leesbaar in 24 talen?’ en ‘Begrijpen patiënten waarom dit vet gedrukt is?’, zijn zonder verder onderzoek moeilijk te beantwoorden. Typografen en grafisch ontwerpers zijn niet gewend om dit soort ‘concrete’ vragen te onderzoeken en te onderbouwen met statistisch significante argumenten.
Weinig publicaties behandelen specifiek de typografische vormgeving van informatie over medicijnen. De meeste adviezen betreffen traditionele boektypografie, typografie voor kranten en tijdschriften en typografie voor bewegwijzeringen. Of deze adviezen ook toepasbaar zijn op bijsluiters en verpakkingen blijft onduidelijk.
Studies over leesbaarheid laten vaak niet zien op welk materiaal ze zijn gebaseerd, blijven vaag over de kenmerken van de deelnemers aan het onderzoek en trekken vaak generaliserende conclusies. Of de resultaten voor meerdere talen gelden blijft onduidelijk, evenmin wordt duidelijk wat de invloed van een sterk gestructureerde / gesegmenteerde tekst is op leespatronen en of ook de interesses en motivaties van lezers van belang zijn.
Het overgrote deel van de gebruikers van medicijnen zijn zoals gezegd de ouderen. Omdat de meeste onderzoeken geen betrekking hebben op proefpersonen boven de pensioengerechtigde leeftijd van 65 of 67 is er weinig bekend over de leesvaardigheden van deze specifieke groep. Contextuele factoren, zoals ‘gezondheidsvaardigheden’ (health literacy), ‘digitale vaardigheden’ en laaggeletterdheid (functionele geletterdheid), spelen bij deze onderzoeken zelden een rol.
Dus, alhoewel er wetenschappelijk onderzoek over typografische vormgeving beschikbaar is, levert het te weinig feitelijke aanwijzingen op om een beleid over typografische vormgeving te ontwikkelen. De ‘wetenschappelijke basis’ zoals die tot nu toe is gepubliceerd, biedt de farmaceutische industrie en de registratie-autoriteiten te weinig houvast.
Een tweede bron die zou kunnen dienen als basis voor typografische adviezen is de stroming in de typografie, die na de Tweede Wereldoorlog tot ontwikkeling kwam en die achteraf werd aangeduid als ‘de Zwitserse school’ of de ‘Internationale Stijl’.23 Opmerkelijk is dat prominente vertegenwoordigers van de Zwitserse typografie in nauwe samenwerking met opdrachtgevers uit de farmaceutische industrie al in de jaren vijftig belangrijke aanzetten hebben gegeven voor een systematische benadering van informatie over geneesmiddelen.
Robert Gessner beschreef deze stijl in 1957 als ‘anonymous style’: ‘They deliberately renounce the manifestation of personal artistic attributes in favour of the legitimate demands of information.’24 Hij typeert de Zwitserse school als een systematisch, gestructureerd, programmatisch en op het stramien gebaseerde benadering van ontwerpen. Visueel kenmerkend is het gebruik van een schreefloze letter — vaak de Helvetica of Univers — en een linkslijnende, asymmetrische opmaak, waarin bewust wordt omgegaan met de witruimte van de pagina. Deze benadering sloot nauw aan bij de eisen die de Zwitserse chemische en farmaceutische industrie, zoals Ciba, Geigy, Hoffmann-La Roche en Sandoz, stelde aan de vormgeving van informatie in advertenties, productinformatie en verpakkingen.25
De invloed van deze stijl is herkenbaar in het werk van veel ontwerpstudio’s in Noord-Europa vanaf de jaren zestig, bijvoorbeeld in het werk van het Nederlandse Total Design en het Britse Octavo. Het is merkwaardig dat men voor de vormgeving van informatie over medicijnen, in tegenstelling tot andere werkterreinen, zoals bewegwijzering, informatievormgeving en user interfaces van programmatuur, geen gebruik gemaakt heeft van de programmatische aanpak van de Internationale Stijl. Vanuit het perspectief van de commerciële ‘branding’ en promotie van de medicijnen is dat begrijpelijk. Visuele veranderingen zijn noodzakelijk om de aandacht te blijven trekken. Echter, vanuit het perspectief van informatieverschaffing en instructieve voorlichting gaat het er om dat patiënten en zorgverleners in staat zijn om correct en veilig te handelen. Duidelijk gestructureerde, eenvoudige en heldere visuele vormgeving wordt door lezers van complexe informatie nog steeds hoog gewaardeerd. De kennis die in de Zwitserse School werd opgedaan zou verder ontwikkeld kunnen worden. Maar ook hier ontbreekt het aan betrouwbare onderzoeksresultaten.26
De typografische kennis en ervaring die in de geschiedenis zijn vergaard en ontwikkeld kunnen daarom (nog) niet als uitgangspunt dienen voor de visuele vormgeving van informatie over medicijnen.
Tot zover de analyse en beschrijving van de redenen waarom de typografische vormgeving van de traditionele, gestandaardiseerde, papieren bijsluiter niet meer voldoet aan de verwachtingen van de verschillende partijen en niet meer in staat is om de maatschappelijke veranderingen te integreren. Nu kan de vraag gesteld worden of de verwachtingen van patiënten, registratie-autoriteiten en farmaceutische industrie verenigbaar zijn en vooral hoe dat kan worden gerealiseerd.
Voor de verbetering van de typografische vormgeving van informatie over medicijnen zijn de volgende vier complementaire activiteiten van belang: (1) stel controleerbare criteria in de wetgeving vast, (2) ontwerp performance based, (3) genereer betrouwbare data en, tot slot, (4) ontwikkel prototypes.
Activiteit 1. Stel controleerbare resultaten vast De Europese wetgeving stelt dat ‘[d]e bijsluiter moet ontworpen en geschreven zijn in duidelijke en begrijpelijke bewoordingen’;27 daarenboven moet ‘de bijsluiter (…) duidelijk leesbaar zijn’ en ‘de gebruiker in staat stellen om het geneesmiddel op de juiste wijze te gebruiken.’ De wetgever beschouwt de typografie dus als integraal onderdeel van het ontwerp. De typografie is echter onderdeel van een complex samenspel van lezers en gebruikers. Om de effectiviteit van de typografie te kunnen beoordelen is het noodzakelijk te bepalen wie de ‘gebruiker’ is, wat ‘gebruiken’ is, wat ‘de juiste wijze’ is en hoe de gebruiker ‘in staat gesteld wordt’?
Er moet, met andere woorden, onderzoek worden gedaan naar specifieke gebruikers: niet alleen patiënten, maar bijvoorbeeld ook familie of mantelzorgers. Voor veel medicijnen kan men een ‘gebruikersprofiel’ en de activiteiten van de gebruikers vastleggen om te bepalen welke activiteiten de grootste risico’s met zich mee brengen en wat het juiste gebruik is. Op basis hiervan kunnen middels papieren bijsluiters instructies worden geschreven die de patiënt en andere betrokkenen ‘in staat stellen om een geneesmiddel op de juiste wijze te gebruiken.’ Maar dit kan ook met behulp van digitale animaties, gsm-applicaties, of het ontwerp van toedieningsapplicaties. Het onderliggend onderzoek op basis van gebruikerstests en patiëntobservaties kan dienen als basis voor ontwerpbeslissingen, en tegelijk als bewijs voor de registratie-autoriteiten dat er aan de wetgeving is voldaan.
Activiteit 2. ‘Performance based’ ontwerpen Performance based ontwerpen wordt al op veel terreinen toegepast en in de literatuur beschreven. In publicaties als Designing for People van Henry Dreyfuss, Victor Papaneks Designing for the Real World en Karen Schrivers Dynamics in Document Design, wordt beargumenteerd dat het betrekken van, in dit geval, patiënten (en betrokkenen) in het ontwerpproces aantoonbaar betere resultaten oplevert.28 De verkregen kennis kan vervolgens worden gebruikt om prototypes te ontwikkelen. Het is goed om bij dit performace based ontwerpen ook de twee andere partijen, de industrie en de registratie-autoriteiten, te betrekken.
Het is duidelijk dat deze benadering ook zal leiden tot een ander soort richtlijnen. Immers adviezen als ‘Choose a font which is easy to read’, zullen worden vervangen door instructies, die stap voor stap aangeven hoe patiënten betrokken worden bij de ontwikkeling van informatie en hoe gemotiveerde ontwerpkeuzes op een gestructureerde manier aan de registratie-autoriteiten gemeld kunnen worden.
Activiteit 3. Genereer betrouwbare data De twee bovenstaande activiteiten maken al duidelijk dat de kennis en ervaring niet generaliserend en algemeen maar specifiek en context gerelateerd moeten zijn. De interpretatie van een tekst hangt immers af van de soort lezer, het type informatie en de context. Veel data waren voornamelijk gebaseerd op individuele opinies en ervaringen, en het betrekken van patiënten bij het ontwerp-proces kan een deel van de twijfel wegnemen. Naast het verzamelen en publiceren van kwalitatieve data is het absoluut nodig om ook kwantitatieve gegevens te verzamelen en te vergelijken. Het is van groot belang dat ook factoren als taalvaardigheid, laag geletterdheid en leeftijd in kaart gebracht worden. Naast het direct typografische onderzoek is er tevens contextueel onderzoek nodig waarin visuele informatie empirisch wordt onderzocht.
Activiteit 4. Ontwikkel prototypes Het ontwikkelen van prototypes is belangrijk om te kunnen aantonen dat de informatie verschilt voor leeftijdsgroepen (junior / senior), talen (niet iedereen in Nederland spreekt Nederlands) en leesvaardigheid (voor zowel hoogopgeleiden als laaggeletterden). Zo heeft bijvoorbeeld een ervaren astmapatiënt, die vrij precies weet hoe ze haar medicijnen moet combineren, andere informatie nodig dan een diabetespatiënt die recentelijk te horen kreeg dat ze insuline moet gaan injecteren. Deze verschillen kunnen visueel herkenbaar worden gemaakt door middel van typografische vormgeving. Op dit moment bestaan er slechts een handvol goede voorbeelden, zoals de diabetespennen voor kinderen en injectiespuiten voor patiënten met artritis.
Gezien het bovenstaande is het onwaarschijnlijk dat alle informatie in één document of in één formaat gepresenteerd kan worden. Informatie kan op verschillende niveaus, met behulp van verschillende visuele vormen, zowel digitaal als op papier worden aangeboden, zodat het optimaal aansluit bij de verschillende activiteiten van patiënten. Dat dit technisch mogelijk is laat het voorbeeld van een telefoonrekening zien. Deze is individueel, iedere maand anders, overzichtelijk, beschikbaar in verschillende formaten (HTML, PDF, papier) en in een taal die de consument zelf kan kiezen. Zoals de eerste vier voorbeelden laten zien, heeft men dit niveau voor medicijneninformatie helaas nog niet bereikt.
Het antwoord op de vraag waarom de letters in bijsluiters zo klein en moeilijk leesbaar zijn is complex. De kleine lettertjes zijn namelijk slechts een symptoom van een grotere problematiek, waarbij drie partijen betrokken zijn met elk uiteenlopende belangen. Voor alle drie is de visuele informatie en de typografische vormgeving belangrijk. Patiënten hebben baat bij betrouwbare en bruikbare informatie, die hen ondersteunt bij het geneesmiddelengebruik. De registratie-autoriteiten hebben nood aan een betrouwbaar systeem, gebaseerd op objectieve criteria om de typografische vormgeving te controleren. De farmaceutische industrie, tenslotte, wil, gedreven door voornamelijk economische motieven, vooral effectieve, efficiënte en aantrekkelijke informatie over geneesmiddelen geven. De huidige bijsluiter voldoet aan geen van deze verwachtingen.
Voor een verandering van deze situatie moet de huidige wetgeving en de historische ontwikkeling van deze wetgeving kritisch worden onderzocht. Het vrije verkeer van goederen in Europa heeft geleid tot een ongewenste standaardisatie van de informatie over medicijnen die geen recht doet aan de verscheidenheid aan patiënten en geneesmiddelen.
Daarnaast is er meer theoretisch en empirisch onderzoek nodig om de kennis en vaardigheden van grafisch ontwerpers en typografen te verbeteren en onderbouwen, maar ook om de andere partijen — de farmaceutische industrie en de registratie-autoriteiten — in staat te stellen een beargumenteerd en pluriform beleid te formuleren. Dit beleid moet, zoals hierboven werd beargumenteerd, zijn gebaseerd op controleerbare resultaten, ‘performance based’ ontwerpen, betrouwbare data en de ontwikkeling van prototypes.
Het introduceren van een nieuwe praktijk die de huidige bijsluiter vervangt vergt tijd. Alhoewel er al een paar voorbeelden bestaan van uitzonderingen op de regel blijft in de tussenliggende periode Walter Modells uitspraak over bijsluiters uit 1967 — nu bijna 50 jaar geleden — van toepassing: ‘The stuffers are generally printed in Lilliputian type and on Bible paper, and are hard to handle, and very difficult to read.’ 29
Karel van der Waarde promoveerde aan de Universiteit van Reading (GB) en is eigenaar van een grafisch ontwerp-onderzoek adviesbureau sinds 1995. Het bedrijf ontwikkelt en test patiënten-bijsluiters, verpakkingen, gebruiksaanwijzingen, formulieren, en de architectuur van websites, voornamelijk voor de farmaceutische industrie. (www.graphicdesign-research.com) Karel van der Waarde doceert aan de Basel School of Design (FHNW) en publiceert regelmatig over visuele informatie vormgeving. Hij is een life-fellow van het Communications Research Institute (Melbourne, Australië), bestuurslid van het International Institute for Information Design (IIID, Vienna, Austria) en redactielid van Information Design Journal, Journal of Communication Design, She Ji en Visible Language.



There are no comments